Åpning av kraften til spenningsstyrte ionekanal ligander: Hvordan disse molekylære dørvokterne revolusjonerer legemiddeloppdagelse og nevrologiske terapier
- Introduksjon: Hva er spenningsstyrte ionekanal ligander?
- Virkningsmekanismer: Hvordan ligander modulerer ionekanalfunksjon
- Terapeutiske applikasjoner: Fra nevrologiske lidelser til hjertearytmier
- Nylige gjennombrudd og fremvoksende forskning
- Utfordringer i liganddesign og selektivitet
- Fremtidige retninger: Neste generasjons ligander og klinisk potensial
- Konklusjon: Den transformative virkningen av spenningsstyrte ionekanal ligander
- Kilder og referanser
Introduksjon: Hva er spenningsstyrte ionekanal ligander?
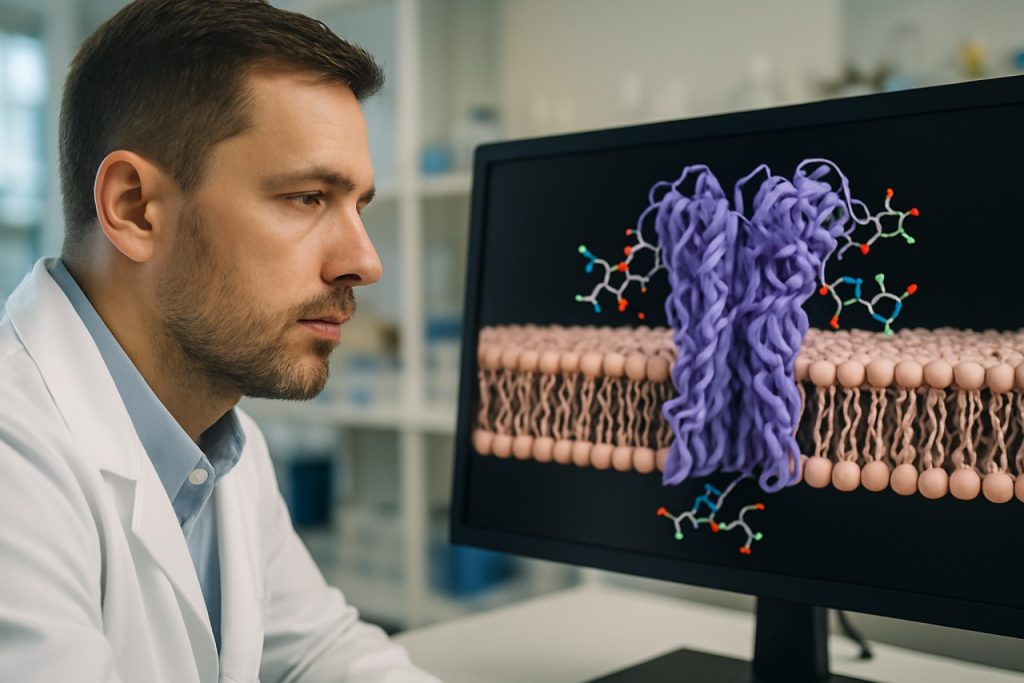
Spenningsstyrte ionekanal ligander er en mangfoldig gruppe molekyler som spesifikt interagerer med spenningsstyrte ionekanaler (VGIC), som er transmembrane proteiner ansvarlige for rask og selektiv strømning av ioner som natrium, kalium, kalsium og klorid over cellemembraner som respons på endringer i membranpotensial. Disse ligandene kan fungere som agonister, antagonister eller modulatorer, og påvirker åpning, lukking eller inaktivering av kanalene, og dermed påvirker cellulær eksitabilitet og signaling. Den fysiologiske og farmakologiske betydningen av VGIC-ligander er dyp, da de spiller kritiske roller i neuronal kommunikasjon, muskelkontraksjon, hormonsekresjon og regulering av hjerterytme.
VGIC-ligander omfatter et bredt spekter av kjemiske enheter, inkludert endogene peptider, små organiske molekyler, toksiner fra dyr (som konussnegler, skorpioner og edderkopper) og syntetiske legemidler. Deres virkningsmekanismer er også varierte, fra direkte blokkering av porene til allosterisk modulering av kanal gating. Spesifisiteten og potencyen til mange naturlige ligander har gjort dem uvurderlige verktøy for å dissekere kanalens funksjon og som ledende forbindelser i legemiddelutvikling. For eksempel utøver visse antikonvulsiva og antiarytmika sine terapeutiske effekter ved å målrette spenningsstyrte natrium- eller kaliumkanaler, mens noen analgetika modulerer spenningsstyrte kalsiumkanaler for å redusere smittoverføring National Center for Biotechnology Information.
Gitt deres sentrale rolle i fysiologi og sykdom, er spenningsstyrte ionekanal ligander et hovedfokus for biomedisinsk forskning, med pågående innsats for å oppdage nye ligander og optimalisere deres terapeutiske potensial for tilstander som epilepsi, kroniske smerter, hjertearytmier og nevrodegenerative lidelser European Medicines Agency.
Virkningsmekanismer: Hvordan ligander modulerer ionekanalfunksjon
Spenningsstyrte ionekanal ligander utøver sine effekter ved å binde seg til spesifikke steder på ionekanalene, og dermed modulere deres gating-egenskaper og ioneleksering. Disse ligandene kan fungere som agonister, antagonister eller allosteriske modulatorer, hver av dem påvirker kanalens funksjon gjennom distinkte mekanismer. Agonister stabiliserer vanligvis den åpne tilstanden til kanalen, noe som forbedrer ionestrøm, mens antagonister blokkerer kanalens pore eller stabiliserer den lukkede eller inaktiverte tilstanden, som reduserer ionpermeabilitet. Allosteriske modulatorer binder seg til steder adskilt fra den primære ion-leder pore, og inducerer konformasjonsendringer som endrer kanalens følsomhet for spenning eller andre ligander.
Interaksjonen mellom ligander og spenningsstyrte ionekanaler involverer ofte høy spesifikk molekylær gjenkjenning, med visse ligander som målretter spesifikke kanalundertyper. For eksempel binder lokale anestetika og antiarytmiske legemidler vanligvis seg inne i den indre poren av spenningsstyrte natriumkanaler, og hindrer ionpassasje og stabiliserer den inaktiverte tilstand, noe som er avgjørende for deres terapeutiske effekter ved smerte og hjertearytmier National Center for Biotechnology Information. Peptidtoxiner fra dyrevenomer, som de fra skorpioner og konussnegler, kan binde seg til ekstracellulære domener og endre kanalens gating eller selektivitet National Institutes of Health.
I tillegg viser noen ligander tilstands-avhengig binding, som fortrinnsvis interagerer med kanaler i spesifikke konformasjoner (f.eks. åpen, lukket eller inaktivert), noe som ligger til grunn for deres bruk-avhengige eller frekvens-avhengige farmakologiske profiler. Denne egenskapen er spesielt relevant for legemidler som retter seg mot hyperaktive eller patologisk fyrende nevroner, som sett i epilepsi eller kroniske smertesyndromer U.S. Food and Drug Administration. Dermed bestemmes den presise mekanismen ved hvilken en ligand modulerer spenningsstyrte ionekanalfunksjoner av dens bindingssted, kanaltilstandspreferanse og de resulterende konformasjonsendringene i kanalproteinet.
Terapeutiske applikasjoner: Fra nevrologiske lidelser til hjertearytmier
Spenningsstyrte ionekanal ligander har vist seg å være avgjørende midler i behandlingen av et bredt spekter av sykdommer, spesielt nevrologiske lidelser og hjertearytmier. Disse ligandene, som inkluderer både små molekyler og biologiske legemidler, modulerer aktiviteten til ionekanaler som natrium-, kalium- og kalsiumkanaler, og påvirker dermed cellulær eksitabilitet og signaling. Innen nevrologi er blokkere av spenningsstyrte natriumkanaler som karbamazepin og lamotrigine hovedkomponenter i behandlingen av epilepsi, og reduserer neuronal hypereksitabilitet og anfallfrekvens. Tilsvarende brukes kalsiumkanalblokkere som gabapentin og pregabalin mye til nevropatisk smerte og visse former for epilepsi, og virker ved å dempe unormal neuronal fyring U.S. Food & Drug Administration.
Innen kardiologi er spenningsstyrte ionekanal ligander essensielle for rytmekontroll. Klasse I og III antiarytmika, slik som lidokain (en natriumkanalblokkere) og amiodaron (en kaliumkanalblokkere), brukes til å behandle livstruende ventrikulære arytmier og atrieflimmer ved å stabilisere hjerteaktionspotensialer og forhindre avvikende elektrisk aktivitet European Medicines Agency. Videre utforsker pågående forskning spesifikke ligander for spesifikke kanalundertyper, med mål om å minimere bivirkninger og forbedre terapeutiske resultater i forhold som kroniske smerter, migrene og arytmisyndromer National Institute of Neurological Disorders and Stroke.
Det utvidende repertoaret av spenningsstyrte ionekanal ligander understreker deres terapeutiske allsidighet og lovnaden av presisjonsmedisinske tilnærminger som retter seg mot kanalsykdommer på tvers av flere organsystemer.
Nylige gjennombrudd og fremvoksende forskning
De siste årene har vitne til betydelige gjennombrudd i oppdagelsen og karakteriseringen av spenningsstyrte ionekanal ligander, drevet av fremskritt innen strukturell biologi, høyhastighets screening og beregningsmodellering. Avsløring av høyoppløselige strukturer av spenningsstyrte natrium-, kalium- og kalsiumkanaler har muliggjort rasjonell legemiddelutvikling, som gjør det mulig for forskere å identifisere nye bindingssteder og utvikle ligander med forbedret spesifisitet og effektivitet. For eksempel har krio-elektronmikroskopi gitt detaljerte innsikter i kanalens konformasjonelle tilstander, som letter design av tilstand-avhengige modulatorer som foretrekker å målrette patologisk kanalaktivitet samtidig som de unngår normal fysiologisk funksjon (Nature).
Fremvoksende forskning har også fokusert på utviklingen av peptid-baserte ligander avledet fra dyrevenomer, som ofte viser høy selektivitet for spesifikke kanalundertyper. Disse peptidene fungerer som verdifulle farmakologiske verktøy og potensielle terapeutiske ledere, spesielt for smerte, epilepsi og hjertearytmier (National Center for Biotechnology Information). I tillegg akselererer fremskritt innen beregningskjemi og maskinlæring identifiseringen av små molekylmodulatorer ved å forutsi ligand-kanal interaksjoner og optimalisere farmakokinetiske egenskaper (Cell Press).
Et annet lovende område er utforskningen av allosteriske modulatorer, som binder seg til steder adskilt fra kanalens pore og tilbyr muligheten for presis kontroll over kanalaktivitet med redusert bivirkninger. Samlet sett utvider disse gjennombruddene det terapeutiske landskapet for spenningsstyrte ionekanal ligander, med flere kandidater som går inn i kliniske studier for nevrologiske, kardiovaskulære og smertelidelser.
Utfordringer i liganddesign og selektivitet
Å designe ligander for spenningsstyrte ionekanaler (VGICs) presenterer betydelige utfordringer, hovedsakelig på grunn av den høye graden av strukturell bevaring blant kanalundertyper og den dynamiske naturen av deres konformasjonsstater. Å oppnå subtype-selektivitet er spesielt vanskelig fordi pore-dannende α-underenheter av VGICs, som de i natrium-, kalium- og kalsiumkanaler, ofte deler svært homologe aminosyresekvenser, spesielt innen de transmembrane domenene som danner ligandbindingsstedene. Denne likheten øker risikoen for off-target effekter, som kan føre til ugunstige bivirkninger eller toksisitet i kliniske applikasjoner National Center for Biotechnology Information.
En annen stor utfordring er den tilstand-avhengige tilgjengeligheten av bindingssteder. Mange ligander binder seg fortrinnsvis til spesifikke kanal-konformasjoner (f.eks., åpne, lukkede eller inaktive tilstander), som er forbigående og påvirket av det fysiologiske miljøet. Denne dynamiske atferden kompliserer prediksjonen og optimaliseringen av ligandens effektivitet og selektivitet Nature Reviews Drug Discovery. I tillegg kan tilstedeværelsen av hjelpestoffer og post-translasjonsmodifikasjoner ytterligere modulere kanalens farmakologi, og legge lag med kompleksitet til rasjonell liganddesign.
Fremskritt innen høyoppløselig strukturell biologi, slik som krio-elektronmikroskopi, har begynt å avsløre subtile forskjeller i kanalarkitektur som kan utnyttes for selektiv ligandmålretting. Imidlertid forblir oversettelse av disse innsiktene til klinisk nyttige forbindelser en formidabel oppgave, som krever iterative sykluser av strukturbasert design, funksjonell screening og in vivo validering Cell Press.
Fremtidige retninger: Neste generasjons ligander og klinisk potensial
Fremtiden for spenningsstyrte ionekanal ligander er klar for betydelig fremgang, drevet av innovasjoner innen molekylær design, høyhastighets screening og presisjonsmedisin. Neste generasjons ligander blir konstruert for forbedret selektivitet, styrke og sikkerhet, som adresserer begrensningene til nåværende terapier som ofte lider av off-target effekter og smale terapeutiske vinduer. Struktur-basert legemiddelutvikling, som utnytter høyoppløselig krio-EM og Røntgenkrystallografi data, gjør det mulig med rasjonell utvikling av ligander som kan skille mellom nært beslektede ionekanal undertyper, potensielt redusere bivirkninger og forbedre effektiviteten Nature Reviews Drug Discovery.
Fremvoksende modaliteter inkluderer allosteriske modulatorer, som binder seg til steder adskilt fra kanalens pore, og tilbyr nyansert kontroll over kanalaktivitet og muligheten for vevs- eller tilstand-avhengig modulering. Peptidomimetikk og biologiske legemidler, inspirert av naturlige toksiner, er også under undersøkelse for deres evne til å målrette ionekanaler med høy spesifisitet Neuron. I tillegg akselererer fremskritt innen beregningsmodellering og maskinlæring identifiseringen og optimaliseringen av nye ligander, mens fenotypisk screening i pasientavledede celler støtter utviklingen av personlige terapier.
Klinisk holder neste generasjons ligander løfter om behandling av et spekter av tilstander, inkludert kroniske smerter, epilepsi, hjertearytmier og nevrodegenerative sykdommer. Pågående kliniske studier evaluerer sikkerheten og effektiviteten av disse midlene, med flere kandidater som viser oppmuntrende resultater i tidlige fases studier U.S. National Library of Medicine. Etter hvert som vår forståelse av ionekanalopatier dypner, vil integreringen av genomikk og farmakologi ytterligere raffinere ligandutvikling, og bane vei for presisjonsmedisinske terapier skreddersydd for individuelle pasientprofiler.
Konklusjon: Den transformative virkningen av spenningsstyrte ionekanal ligander
Spenningsstyrte ionekanal ligander har dukket opp som transformative midler både i grunnleggende nevrovitenskapelig forskning og kliniske terapier. Ved å selektivt modulerer aktiviteten til ionekanaler, har disse ligandene muliggjort enestående innsikter i mekanismene for neuronal eksitabilitet, synaptisk overføring, og patofysiologien til mange nevrologiske og kardiovaskulære lidelser. Deres spesifisitet og potency har gjort dem uvurderlige verktøy for å dissekere rollene til individuelle kanalundertyper, og lette utviklingen av målrettede intervensjoner for tilstander som epilepsi, kroniske smerter, arytmier og visse psykiatriske lidelser (National Center for Biotechnology Information).
Klinisk har bruken av spenningsstyrte ionekanal ligander ført til godkjenning av flere første i klassen legemidler, inkludert antikonvulsiva, antiarytmika og analgetika, som har betydelig forbedret pasientresultater. Videre akselererer pågående fremskritt innen strukturell biologi og høyhastighets screening oppdagelsen av nye ligander med forbedrede selektivitets- og sikkerhetsprofiler (U.S. Food and Drug Administration). Integreringen av beregningsmodellering og presisjonsmedisinske tilnærminger lover å ytterligere raffinere liganddesign, minimere bivirkninger samtidig som terapeutisk effektivitet maksimeres.
Kort sagt, spenningsstyrte ionekanal ligander representerer en hjørnestein i moderne farmakologi og nevrovitenskap. Deres fortsatte utvikling har potensial til å revolusjonere behandlingen av et bredt spekter av sykdommer, og understreker deres varige innvirkning på både vitenskapelig forståelse og klinisk praksis (National Institute of Neurological Disorders and Stroke).
Kilder og referanser
- National Center for Biotechnology Information
- European Medicines Agency
- Nature
- U.S. National Library of Medicine



